Lonza Nucleofector 2b單孔細胞核轉(zhuǎn)染系統(tǒng)
——原代細胞、難轉(zhuǎn)染細胞系高效轉(zhuǎn)染解決方案
北京澤平代理的德國進口Lonza Nucleofector 2b單孔細胞核轉(zhuǎn)染系統(tǒng)(原Amaxa Nucleofector II/2b Device�����,又稱Lonza 2b細胞核轉(zhuǎn)儀�����、Lonza 2b細胞電轉(zhuǎn)儀)�, 作為全球知名的高效基因電轉(zhuǎn)儀�,其利用傳統(tǒng)電穿孔原理,結(jié)合細胞特異性電轉(zhuǎn)染液����,可以將包括DNA、RNA��、質(zhì)粒��、多肽���、蛋白質(zhì)�����、核糖核蛋白復(fù)合體RNP�����、小分子化合物等轉(zhuǎn)入細胞質(zhì)中��,并穿過核膜直接進入細胞核中���,實現(xiàn)高效轉(zhuǎn)染�,稱為Nucleofector核轉(zhuǎn)染技術(shù)(Nucleofection)���。其中質(zhì)粒DNA轉(zhuǎn)染效率最高達到90%�、寡核苷酸如siRNA轉(zhuǎn)染效率最高達到99%���。
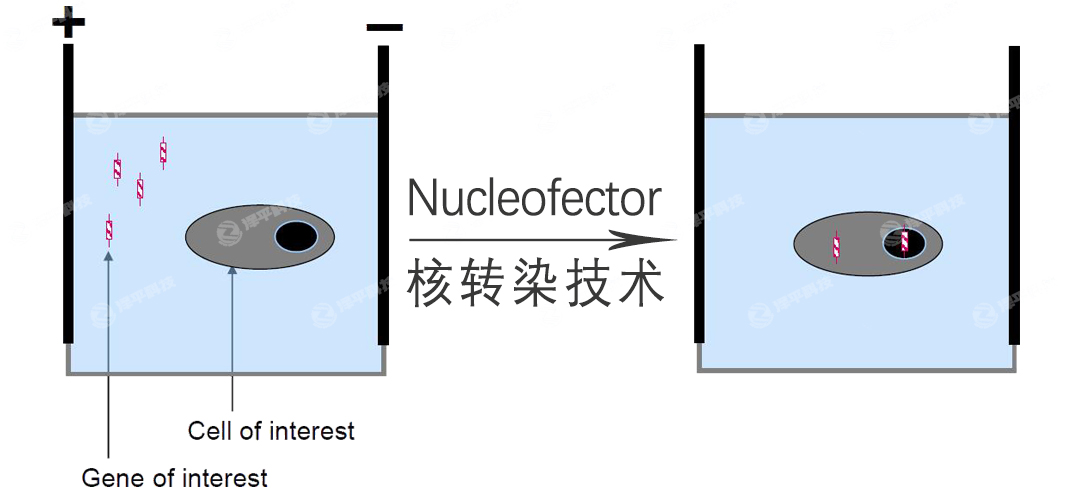
Lonza 2b電轉(zhuǎn)儀自2001年上市以來���,廣泛用于包括干細胞、神經(jīng)細胞���、T淋巴細胞在內(nèi)的動物原代細胞和難轉(zhuǎn)染的細胞系����,以及細菌�����、外泌體轉(zhuǎn)染中��,助力CAR-T����、CAR-NK、CRISPR/Cas9基因編輯�、IPS重編程、RNA干擾�����、外泌體遞送等多種前沿研究�����,全球發(fā)表文章超過14,000篇����。

2b電轉(zhuǎn)儀不依賴于有絲分|裂,尤其適合不分化細胞���,如靜止的T淋巴細胞���、神經(jīng)細胞等���,最快2小時可觀察到蛋白表達。相比脂質(zhì)體轉(zhuǎn)染�����、病毒轉(zhuǎn)導(dǎo)�、傳統(tǒng)電穿孔儀,Lonza 2b電轉(zhuǎn)儀操作簡單��,重復(fù)性高�����,在原代細胞和細胞系中實現(xiàn)更高轉(zhuǎn)染效率���、更高細胞活率�、更快基因表達�,加快推進實驗進程。
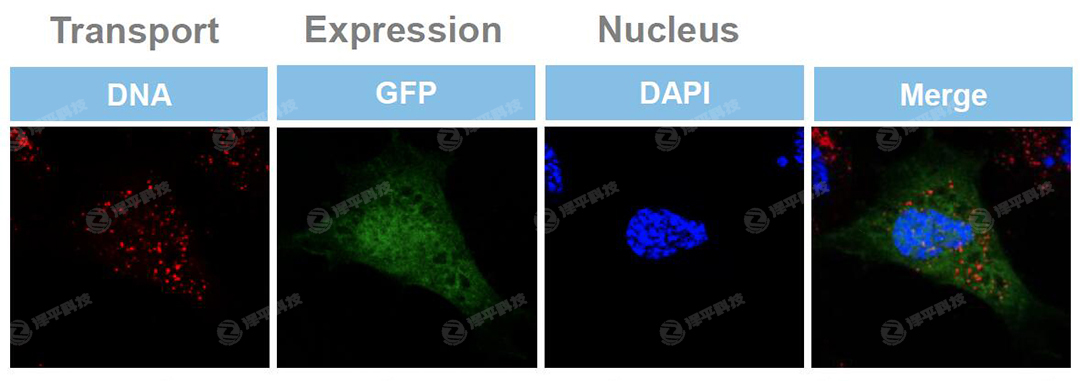
Fig. Primary NHDF-neo cells were transfected with labeled plasmid DNA encoding GFP, fixed after 2h in 3.5%PFA and analyzed by confocal microscopy.
Lonza Nucleofector核轉(zhuǎn)染技術(shù)依托電轉(zhuǎn)儀設(shè)備����、電轉(zhuǎn)染試劑盒、全球共享數(shù)據(jù)庫三方面技術(shù)和資源優(yōu)勢�,實現(xiàn)高效�、靈活���、方便的細胞轉(zhuǎn)染體驗。

①2b電轉(zhuǎn)儀——內(nèi)置針對不同細胞類型優(yōu)化的電脈沖程序�,無需人工設(shè)置電壓電流等電擊參數(shù),無需摸索轉(zhuǎn)染條件�,選定程序一鍵操作,實驗過程簡單方便����。
②電轉(zhuǎn)染試劑盒——Lonza 2b電轉(zhuǎn)染試劑盒由電極杯(電轉(zhuǎn)杯)、電轉(zhuǎn)染緩沖液��、補充劑�、pmaxGFP陽性對照質(zhì)粒、巴氏吸管組成����。其電轉(zhuǎn)緩沖液配方根據(jù)原代細胞、細胞系類型單獨優(yōu)化�����,每種試劑盒用于不同細胞類型��,以提高轉(zhuǎn)染效率、轉(zhuǎn)染后細胞活率��,支持多種底物共轉(zhuǎn)染����,實驗結(jié)果具備高重復(fù)性。
③全球共享數(shù)據(jù)庫——線上實時數(shù)據(jù)庫(https://knowledge.lonza.com)�,可查詢超過759種細胞的轉(zhuǎn)染全流程數(shù)據(jù),包括轉(zhuǎn)染前細胞來源�、傳代、培養(yǎng)條件���、轉(zhuǎn)染程序選擇和操作技巧�、轉(zhuǎn)染后培養(yǎng)條件�、歷史轉(zhuǎn)染結(jié)果等,資源不斷更新�,豐富便捷的數(shù)據(jù)參考,提高實驗效率�,幫助科研人員專注于研究本身。
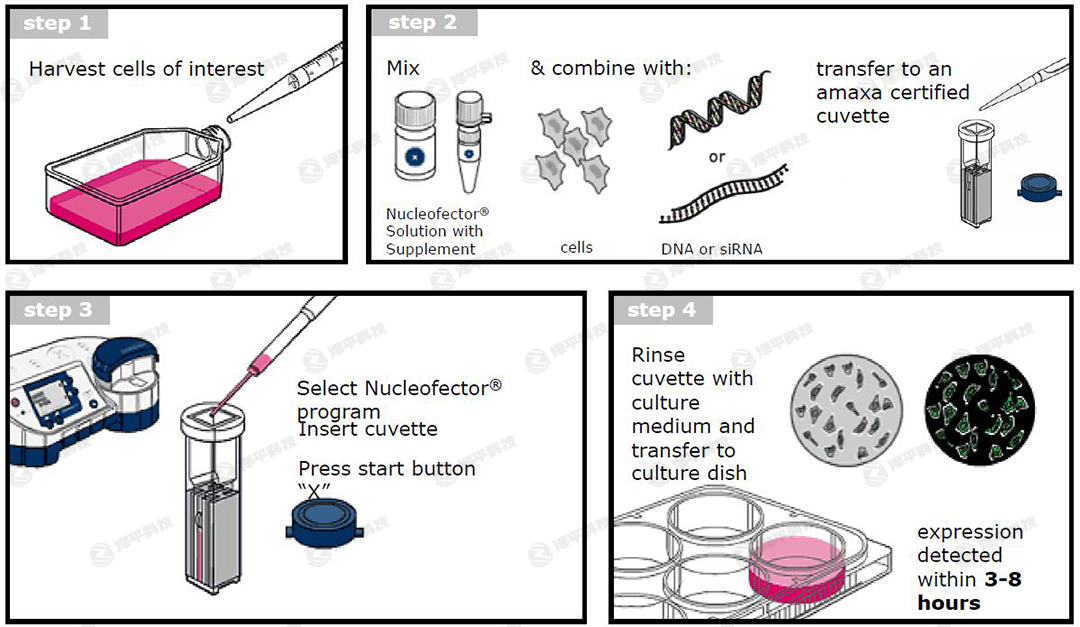
Lonza 2b細胞電轉(zhuǎn)儀轉(zhuǎn)染操作流程
Lonza 2b電轉(zhuǎn)儀參數(shù)
| 品牌 |
龍沙Lonza |
| 產(chǎn)地 |
德國科隆 |
| 中文名稱 |
Nucleofector 2b單孔細胞核轉(zhuǎn)染系統(tǒng) |
| 英文名稱 |
Nucleofector II/2b Device |
| 型號 |
II/2b |
| 貨號 |
AAB-1001 |
| 分類 |
基因電穿孔轉(zhuǎn)染儀器 |
| 用途 |
懸浮細胞��、貼壁細胞消化后轉(zhuǎn)染 |
| 通量 |
單個樣本 |
| 反應(yīng)體系 |
100μL |
| 細胞數(shù)量 |
105至107 |
| 適用細胞 |
①動物原代細胞��、細胞系��,物種包括各類哺乳動物、雞�、斑馬魚、果蠅等 |
| ②原核微生物細菌 |
| ③外泌體等 |
| 轉(zhuǎn)染底物 |
DNA�����、RNA(mRNA���、miRNA、siRNA等)�����、質(zhì)粒�����、多肽���、蛋白質(zhì)�、核糖核蛋白復(fù)合體RNP�、小分子化合物 |
| 尺寸 |
30×23×11cm |
| 重量 |
2.8kg |
| 電源 |
240V-110V,50-60Hz��,自我調(diào)節(jié) |
| 銷售授權(quán) |
中國大陸一級代理商(不含港澳臺) |
| 貨期 |
大量現(xiàn)貨 |
| 服務(wù) |
售前技術(shù)咨詢,裝機�,售后服務(wù)(售后限北京澤平銷售儀器) |
引用文獻
1. Korbinian N. Kropp, et al.(2023) Targeting the melanoma-associated antigen CSPG4 with HLA-C*07:01-restricted T-cell receptors. https://doi.org/10.3389/fimmu.2023.1245559
2. Stephan Riesenberg, et al.(2023) Efficient high-precision homology-directed repair-dependent genome editing by HDRobust. https://doi.org/10.1038/s41592-023-01949-1
3. Kui Zhao, et al.(2023) Generation of an NSD2-deficient human embryonic stem cell line using CRISPR/Cas9 technology. https://doi.org/10.1016/j.scr.2023.103255
4. Meiling Jiang, et al.(2023) Generation of a homozygous RANGRF knockout hiPSC line by CRISPR/Cas9 system. https://doi.org/10.1016/j.scr.2023.103136
5. Xingjie Ren, et al.(2023) Efficient bi-allelic tagging in human induced pluripotent stem cells using CRISPR. https://doi.org/10.1016/j.xpro.2023.102084
6. Ittetsu Nakajima, et al.(2023) In Vivo Delivery of Therapeutic Molecules by Transplantation of Genome-Edited Induced Pluripotent Stem Cells. https://doi.org/10.1177/09636897231173734
7. Shidong Qiu, et al.(2023) Generation of the induced pluripotent stem cell line SFMUi001-A from a patient with usher syndrome type 2 caused by biallelic variants in the USH2A gene. https://doi.org/10.1016/j.scr.2023.103101
8. Chiami Moyama, et al.(2023) Myb Repression Mediates Stat5b-knockdown-induced Apoptosis and Inhibits Proliferation of Glioblastoma Stem Cells. https://doi.org/10.21873/cgp.20374
9. Saito, M.K., et al.(2023) A disease-specific iPS cell resource for studying rare and intractable diseases. https://doi.org/10.1186/s41232-023-00294-2
10. Joseph T. Smith, et al.(2023) Developmental dynamics of mitochondrial mRNA abundance and editing reveal roles for temperature and the differentiation-repressive kinase RDK1 in cytochrome oxidase subunit II mRNA editing. https://doi.org/10.1128/mbio.01854-23
更多Lonza 2b電轉(zhuǎn)儀信息,歡迎點擊右側(cè)在線咨詢
——Lonza中國一級代理商�����,北京澤平
相關(guān)產(chǎn)品
Lonza 4D電轉(zhuǎn)儀
Lonza 384孔電轉(zhuǎn)儀